Wiązka zadań
Pręt miedziany
Zadanie
Nauczyciel włożył pręcik z metalicznej miedzi do zlewki z roztworem azotanu(V) srebra. Po pewnym czasie na zanurzonej części pręta pojawiły się szare kryształki, natomiast sam roztwór zabarwił się na niebiesko. Temperatura zlewki i wskazanie wagi nie uległy zmianie.
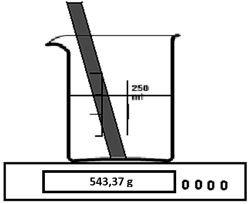
Które z poniższych stwierdzeń wynikają z tego doświadczenia?
| Lp. | Stwierdzenie | Czy można to wywnioskować na podstawie opisanego doświadczenia? |
| 1. | Wszystkie związki zawierające jony miedzi posiadają barwę niebieską. | `square` Tak / `square` Nie |
| 2. | W tej reakcji nie powstają produkty gazowe. | `square` Tak / `square` Nie |
| 3. | Reakcja pręta miedzianego z roztworem azotanu(V) srebra jest reakcją egzotermiczną. | `square` Tak / `square` Nie |
Poprawna odpowiedź
1. Nie
2. Tak
3. Nie
Wymaganie ogólne
2.1 Rozumowanie i zastosowanie nabytej wiedzy do rozwiązywania problemów. Uczeń opisuje właściwości substancji i wyjaśnia przebieg prostych procesów chemicznych;
3.1 Opanowanie czynności praktycznych. Uczeń bezpiecznie posługuje się prostym sprzętem laboratoryjnym i podstawowymi odczynnikami chemicznymi;
3.2 Opanowanie czynności praktycznych. Uczeń projektuje i przeprowadza proste doświadczenia chemiczne.
Wymaganie szczegółowe
Komentarz
Zdolność do wnikliwej obserwacji i wyciągania prawidłowych wniosków z doświadczeń jest jedną z najważniejszych umiejętności, jakie powinien wykształcić uczeń w toku nauczania. Celem tego zadania było zbadanie wyżej wymienionych umiejętności. Tematyka opisana w doświadczeniu jest nowością dla uczniów gimnazjów, ponieważ w podstawie programowej dla III etapu nauczania nie przewidziano omawiania ogniw elektrochemicznych ani szeregu napięciowego metali. Niemniej, rozwiązanie zadania nie powinno sprawić uczniom trudności, ponieważ wszystkie wyniki eksperymentu podano we wstępie. Uczniowie nie muszą ani wskazywać produktów reakcji, ani pisać równań reakcji chemicznych. Do prawidłowego rozwiązania tego zadania wystarczy, że uczniowie będą wiedzieć, że miedź nie jest szara, chociaż jest metalem, a fakt, że roztwór zabarwił się na niebiesko, nie oznacza, że wszystkie związki zawierające jony miedzi mają taką samą barwę. Po przeczytaniu wstępu do zadania uczniowie powinni umieć zidentyfikować oznaki zajścia reakcji chemicznej (tzn. utworzenie szarych kryształów i zabarwienie roztworu na niebiesko), jak również zinterpretować brak zmian we wskazaniach wagi i termometru. Na podstawie stwierdzenia, że „temperatura zlewki i wskazanie wagi nie uległy zmianie”, można wysnuć następujące wnioski: a) w wyniku reakcji nie powstały żadne produkty gazowe (masa zlewki pozostała stała podczas eksperymentu); b) reakcji nie towarzyszyły efekty cieplne (temperatura zlewki nie uległa zmianie).
Jak odpowiadali uczniowie?
Standaryzację zadania przeprowadzono na grupie 603 uczniów. W poniższej tabeli przedstawiono rozkład procentowy odpowiedzi uczniów.
| Lp. | Stwierdzenie | Czy można to wywnioskować na podstawie opisanego doświadczenia? |
| 1. | Wszystkie związki zawierające jony miedzi posiadają barwę niebieską. | Tak (51,6%) / Nie (46,6%) |
| 2. | W tej reakcji nie powstają produkty gazowe. | Tak (55,9%) / Nie (43,0%) |
| 3. | Reakcja pręta miedzianego z roztworem azotanu(V) srebra jest reakcją egzotermiczną. | Tak (50,1%) / Nie (48,3%) |
Tabela 1. Rozkład procentowy odpowiedzi uczniów na pytania postawione w poleceniu do zadania (właściwe odpowiedzi zaznaczono pogrubionym drukiem).
Odsetek uczniów, którzy prawidłowo rozwiązali całe zadanie, wyniósł 17,7%. Uzyskany wynik był niewiele wyższy od prawdopodobieństwa przypadkowego udzielenia prawidłowej odpowiedzi, wynoszącego 1/8. Rozkład wyników w każdym wierszu również był zbliżony do losowego (50:50).
Na wykresie zamieszczonym poniżej przedstawiono procent poprawnych odpowiedzi (tzn. prawidłowych dla wszystkich trzech wierszy) udzielonych przez uczniów podzielonych na osiem równolicznych grup. Uczniowie z grupy pierwszej uzyskali najniższe średnie wyniki w całym teście, a z grupy ósmej – najwyższe.
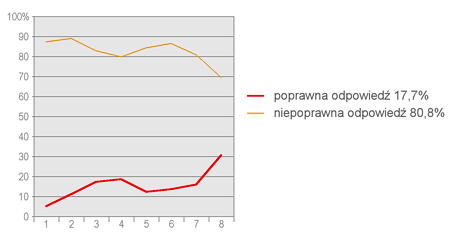
Na podstawie wykresu można wywnioskować, że zadanie w małym stopniu różnicuje badanych uczniów. Uczniowie ze wszystkich grup uzyskali słabe wyniki i tylko w przypadku uczniów z grupy ósmej odsetek prawidłowych odpowiedzi był wyraźnie wyższy. Analiza podobnych wykresów wykonanych dla poszczególnych wierszy w tabeli pokazała, że pierwsza odpowiedź była wybierana przypadkowo we wszystkich grupach uczniów, druga odpowiedź również była zgadywana (z wyjątkiem grupy 8), natomiast w przypadku stwierdzenia trzeciego uczniowie w grupach 1-6 odpowiadali na wyrównanym poziomie, nie przekraczającym 40% odpowiedzi prawidłowych, a w grupach 7 i 8 odsetek odpowiedzi prawidłowych wyniósł odpowiednio 54,5% oraz 72,9%.
Taki wynik może świadczyć o tym, że badani uczniowie nie prowadzili w klasach rzeczywistych doświadczeń i nie byli uczeni metodologii przeprowadzania eksperymentów. Na przykład nie można wyciągać wniosków o właściwościach wszystkich związków miedzi na podstawie jednego eksperymentu, a jednak uczniowie mogą mieć takie błędne przekonanie. Wynika to prawdopodobnie z faktu, że w czasie lekcji bardzo często teorie (prawa) są wprowadzane za pomocą pojedynczego eksperymentu, który służy nie tylko za przykład, ale wręcz za wskaźnik uniwersalnej reguły. Zważywszy, że nowa podstawa programowa dla przedmiotu chemia kładzie szczególny nacisk na samodzielne wykonywanie przez uczniów eksperymentów na lekcjach, sytuacja powinna się poprawiać w kolejnych latach.
Utwór jest chroniony prawem autorskim. Zasady i warunki korzystania z niego określa Regulamin Serwisu Bazy Dobrych Praktyk.
"Masz uwagi do treści? Uważasz, że zawiera błąd? Napisz na bnd@ibe.edu.pl





