Wiązka zadań
Reakcja kwasu z zasadą
Na zajęciach uczniowie przeprowadzili następujące doświadczenie: do kolby wlali 2 cm3 roztworu kwasu solnego, dodali 3 krople fenoloftaleiny, a następnie dodawali porcjami roztwór zasady sodowej, NaOH. Stężenia kwasu i zasady zostały tak dobrane, że ilość jonów H+ w danej objętości kwasu była identyczna jak ilość jonów OH- w takiej samej objętości zasady.
Zmiany objętości całego roztworu w kolbie oraz objętości dodanej zasady sodowej NaOH przedstawiono na wykresach poniżej.
Zadanie 1
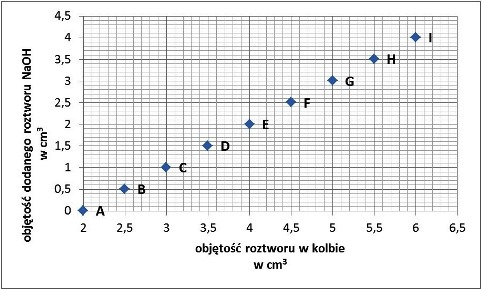
Jaki kolor miał roztwór z fenoloftaleiną podczas kolejnych etapów doświadczenia opisanych punktami z wykresu?
| Punkt z wykresu | Barwa fenoloftaleiny |
| 1. Punkt A | `square` A. malinowa / `square` B. bezbarwna |
| 2. Punkt C | `square` A. malinowa / `square` B. bezbarwna |
| 3. Punkt F | `square` A. malinowa / `square` B. bezbarwna |
| 4. Punkt G | `square` A. malinowa / `square` B. bezbarwna |
Poprawna odpowiedź
1. B,
2. B,
3. A,
4. A
Wymaganie ogólne
1.1 Pozyskiwanie, przetwarzanie i tworzenie informacji. Uczeń pozyskuje i przetwarza informacje z różnorodnych źródeł z wykorzystaniem technologii informacyjno – komunikacyjnych.
2.1 Rozumowanie i zastosowanie nabytej wiedzy do rozwiązywania problemów. Uczeń opisuje właściwości substancji i wyjaśnia przebieg prostych procesów chemicznych;
2.3 Rozumowanie i zastosowanie nabytej wiedzy do rozwiązywania problemów. Uczeń wykonuje proste obliczenia dotyczące praw chemicznych.
Wymaganie szczegółowe
6.6 Kwasy i zasady. Uczeń wskazuje na zastosowania wskaźników (fenoloftaleiny, wskaźnika uniwersalnego)/ rozróżnia doświadczalnie kwasy i zasady za pomocą wskaźników.
6.7 Kwasy i zasady. Uczeń wymienia rodzaje odczynu roztworu i przyczyny odczynu kwasowego, zasadowego i obojętnego.
6.8 Kwasy i zasady. Uczeń interpretuje wartość pH w ujęciu jakościowym (odczyn kwasowy, zasadowy, obojętny)/ wykonuje doświadczenie, które pozwoli zbadać pH produktów występujących w życiu codziennym człowieka (żywność, środki czystości itp.).
7.1 Sole. Uczeń wykonuje doświadczenie i wyjaśnia przebieg reakcji zobojętniania (np. HCl + NaOH).
Komentarz
Prezentowane zadanie znacznie odbiega od typowych zadań dotyczących reakcji zobojętniania, które głównie sprowadzają się do zapisu i zbilansowania równań reakcji pomiędzy kwasem a zasadą. W tym przypadku uczeń musi przewidzieć, jaki będzie odczyn roztworu powstałego po zmieszaniu kwasu i zasady w stosunkach niestechiometrycznych (nie wynikających z równania reakcji chemicznej). Aby wspomóc ucznia w tym przewidywaniu, wyraźnie podkreślono, że ilość reagujących ze sobą jonów w tych samych objętościach kwasu i zasady są identyczne. Na podstawie znajomości przebiegu reakcji pomiędzy jonami wodorowymi i wodorotlenkowymi uczeń ma wywnioskować, że jeśli do 2 cm3 kwasu doda się mniej niż 2 cm3 roztworu zasady, to nie wszystkie jony wodorowe pochodzące z kwasu zostaną zobojętnione przez dodane jony wodorotlenkowe – część z nich pozostanie nadal w roztworze (roztwór będzie miał odczyn kwasowy, a fenoloftaleina nie zabarwi się). W przypadku, gdy do roztworu kwasu solnego dodana zostanie większa niż 2 cm3 objętość zasady sodowej, jonów wodorotlenkowych będzie więcej niż wodorowych. Pewna ilość jonów wodorotlenkowych zobojętni wszystkie jony wodorowe, a pozostała część zostanie w roztworze (fenoloftaleina przyjmie barwę malinową).
Pytanie to sprawdza nie tylko wiadomości, ale także umiejętność odczytywania i przetwarzania danych uzyskanych z wykresu. Aby dobrze rozwiązać zadanie, uczeń powinien w pierwszym etapie prawidłowo odczytać objętość dodanego roztworu zasady sodowej. W kolejnym – porównać objętości roztworów: kwasu i zasady. Następnie wywnioskować, że roztwór, którego jest więcej, decyduje o odczynie roztworu, a na końcu ustalić barwę fenoloftaleiny.
Przed przystąpieniem do pracy nad zadaniem uczeń koniecznie musi wiedzieć, że:
- jony wodorotlenkowe reagują z jonami wodorowymi w stosunku 1 : 1,
- w roztworze zawierającym jony wodorotlenkowe fenoloftaleina przyjmuje barwę malinową, a w roztworze, w którym występują w nadmiarze jony wodorowe (albo żadne z wymienionych), fenoloftaleina jest bezbarwna. Ponadto uczeń musi umieć odczytywać dane liczbowe z wykresu oraz dokonywać operacji myślowych, które doprowadzą go do opisanych na początku wniosków. Niespełnienie któregokolwiek z tych warunków sprawi, że uczniowi nie uda się rozwiązać tego zadania.
Jak odpowiadali uczniowie
Badanie zadania przeprowadzono na grupie 136 uczniów z klas III gimnazjum. W tabeli 1 przedstawiono rozkład procentowy odpowiedzi uczniów.
| Punkt z wykresu | Barwa fenoloftaleiny |
| 1. Punkt A | A. malinowa (39,0%) / B. bezbarwna (59,5%) |
| 2. Punkt C | A. malinowa (52,2%) / B. bezbarwna (46,3%) |
| 3. Punkt F | A. malinowa (52,9%) / B. bezbarwna (45,6%) |
| 4. Punkt G | A. malinowa (58,1%) / B. bezbarwna (40,4%) |
Tabela 1. Rozkład procentowy odpowiedzi uczniów na pytania postawione w poleceniu do zadania (właściwe odpowiedzi zaznaczono pogrubionym drukiem).
Zadanie okazało się trudne dla uczniów; prawidłowo (na wszystkie cztery pytania) odpowiedziało tylko 26,5% badanej młodzieży. Podpunkt 1 dotyczył zabarwienia fenoloftaleiny w roztworze kwasu. Jednak to uczeń musiał stwierdzić, że w poleceniu chodzi właśnie o ten roztwór – na podstawie wykresu musiał odczytać objętość roztworu zasady (0 cm3) i stwierdzić, że nie dodano jeszcze zasady do roztworu kwasu.
Istnieje kilka możliwych przyczyn, dla których uczniowie nie odpowiedzieli poprawnie na pytanie w podpunkcie 1:
- zapomnieli, że początkowy roztwór to roztwór kwasu,
- nie potrafili odczytać z wykresu objętości roztworu zasady i/lub zinterpretować tej wartości,
- zapomnieli, że fenoloftaleina w roztworze kwasu jest bezbarwna.
Pozostałe podpunkty (2, 3 i 4) dotyczyły sytuacji, w których uczniowie musieli określić odczyn roztworu powstałego po zmieszaniu nierównowagowych ilości kwasu i zasady. W każdym przypadku obowiązywał ten sam schemat działania: odczytanie objętości roztworu zasady, porównanie z objętością kwasu i ustalenie, które z jonów (wodorowe czy wodorotlenkowe) pozostają w roztworze po zmieszaniu, a następnie określenie barwy fenoloftaleiny. Wyniki wskazują, że uczniowie nie poradzili sobie dobrze z tą częścią zadania – procent podających poprawną odpowiedź był następujący: 2 – 46%, 3 – 53%, 4 – 58%. Wszystkie te wartości są bliskie rozkładu losowego, co w połączeniu z faktem, że zadanie nie różnicowało uczniów pod względem umiejętności, wskazuje, że większość uczniów „strzelała”.
Wydaje się, że główną przyczyną błędnych odpowiedzi wcale nie była nieznajomość barwy fenoloftaleiny w roztworach o różnym odczynie, tylko brak umiejętności przetwarzania informacji odczytanych z wykresu oraz prowadzenia rozważań na temat efektów reakcji pomiędzy nierównoważnymi ilościami reagentów. Można sądzić, że były to podstawowe czynniki, które wpłynęły na słabą rozwiązywalność podpunktów 2, 3 i 4.
Z uwagi na złożoność, zadanie to powinno być rozwiązywane wspólnie z nauczycielem (np. podczas omawiania reakcji zobojętniania lub powtarzania działu „Kwasy i zasady”). Będzie to dobra okazja do podniesienia kompetencji uczniów w zakresie selektywnego wykorzystania danych przedstawionych w różnej formie oraz oceniania wyników reakcji pomiędzy reagentami zmieszanymi w nierównowagowych ilościach.
Aby zapobiec sytuacji, w której zadanie zostanie nierozwiązane tylko dlatego, że uczeń zapomni, jaka jest barwa fenoloftaleiny w roztworach o różnym odczynie, można dodać schemat (nie opis słowny), z którego uczeń mógłby odczytać tę barwę, np.:
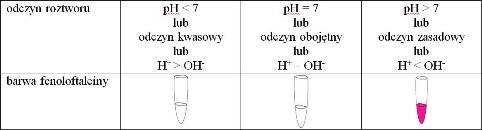
lub jeszcze inaczej:

Zadanie można rozbudować o kilka dodatkowych pytań, które mogłyby naprowadzić uczniów na właściwy tok rozumowania, a jednocześnie pomogłyby ocenić, które czynności sprawiają im trudność. Pytania te sprawdzałyby, czy uczeń:
- zna zabarwienie fenoloftaleiny w roztworach kwasów i zasad,
- potrafi z wykresu odczytać objętość roztworu zasady,
- umie porównać ilość jonów wodorotlenkowych w dodanej objętości roztworu zasady z ilością jonów wodorowych w roztworze kwasu (wskazać, których jonów było więcej/mniej),
- zna przebieg reakcji pomiędzy jonami wodorowymi i wodorotlenkowymi (stosunek stechiometryczny),
- potrafi przewidzieć, które jony pozostaną w roztworze po zmieszaniu nierównowagowych ilości zasady i kwasu.
Zadanie 2
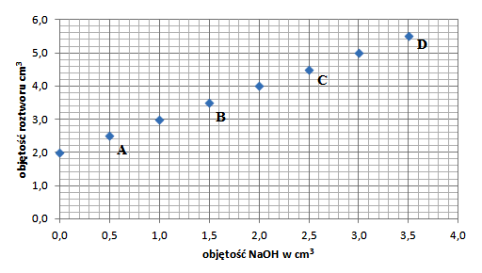
Jakim punktem lub punktami na wykresie opisany jest skład roztworu, dla którego fenoloftaleina ma barwę malinową?
`square` A. Tylko punkt A
`square` B. Tylko punkty A i B
`square` C. Tylko punkt C
`square` D. Tylko punkty C i D
Poprawna odpowiedź
D
Wymaganie ogólne
1.1 Pozyskiwanie, przetwarzanie i tworzenie informacji. Uczeń pozyskuje i przetwarza informacje z różnorodnych źródeł z wykorzystaniem technologii informacyjno – komunikacyjnych.
2.3 Rozumowanie i zastosowanie nabytej wiedzy do rozwiązywania problemów. Uczeń wykonuje proste obliczenia dotyczące praw chemicznych.
Wymaganie szczegółowe
6.6 Kwasy i zasady. Uczeń wskazuje na zastosowania wskaźników (fenoloftaleiny, wskaźnika uniwersalnego)/ rozróżnia doświadczalnie kwasy i zasady za pomocą wskaźników.
6.7 Kwasy i zasady. Uczeń wymienia rodzaje odczynu roztworu i przyczyny odczynu kwasowego, zasadowego i obojętnego.
6.8 Kwasy i zasady. Uczeń interpretuje wartość pH w ujęciu jakościowym (odczyn kwasowy, zasadowy, obojętny)/ wykonuje doświadczenie, które pozwoli zbadać pH produktów występujących w życiu codziennym człowieka (żywność, środki czystości itp.).
7.1 Sole. Uczeń wykonuje doświadczenie i wyjaśnia przebieg reakcji zobojętniania (np. HCl + NaOH).
Komentarz
Podobnie jak w Zadaniu 1, badana jest umiejętność odczytywania i przetwarzania danych z wykresu. Uczeń ma wskazać, w którym momencie miareczkowania roztworu kwasu solnego zasadą sodową pojawi się malinowa barwa fenoloftaleiny, charakterystyczna dla odczynu zasadowego. Do poprawnego rozwiązania zadania:
- potrzebna jest wiedza o zmianach barwy fenoloftaleiny w roztworach w zależności od odczynu roztworu (kwasowego, obojętnego, zasadowego);
- potrzebna jest wiedza o reakcji zobojętniania, a zwłaszcza informacja, że kationy H+ (pochodzące od kwasu) reagują z jonami OH- (pochodzącymi od zasady) w stosunku 1:1;
- należy odczytać z wykresu objętość dodanej zasady sodowej w poszczególnych punktach miareczkowania i porównać ją z objętością kwasu solnego, który należy zobojętnić (2 cm3);
- należy wywnioskować, że tam gdzie objętość dodanej zasady sodowej będzie większa niż objętość kwasu, odczyn roztworu stanie się zasadowy, a barwa fenoloftaleiny zmieni się z bezbarwnej na malinową – na wykresie zaznaczono dwa takie punkty: punkt C (2,5cm3 NaOH) oraz punkt D (3,5cm3 NaOH), a więc odpowiedzią poprawną jest odpowiedź D.
Jak odpowiadali uczniowie
Zadanie zostało przebadane na grupie 170 uczniów klas III gimnazjum. W badaniu uzyskano następujące wyniki (gwiazdką zaznaczono odpowiedź poprawną):
| Odpowiedz | Procent wyboru [%] |
| A | 20,0 |
| B | 41,2 |
| C | 12,4 |
| D* | 26,5 |
Zadanie okazało się bardzo trudne dla uczniów – zaledwie 26,5% odpowiedziało poprawnie. Co więcej, uczniów, którzy wybrali dystraktor B, było ponad 41%. Dystraktory A i B były szczególnie często wybierane przez uczniów, którzy uzyskali najsłabsze wyniki z całego testu. Natomiast uczniowie, którzy uzyskali najlepsze wyniki z testu, najczęściej wskazywali odpowiedzi D i B. Wydaje się, że większość uczniów zapomniała, że fenoloftaleina w roztworze kwasowym jest bezbarwna, a malinowa staje się dopiero w roztworze zasadowym, a więc przyczyną słabych wyników był brak wiadomości, dodatkowo wzmocniony problemami z odczytem informacji z wykresu.
Odsetek odpowiedzi poprawnych zbieżny jest z wynikami dla zadania 1, co każe przypuszczać, że temat reakcji kwasów z zasadami oraz interpretacja obserwacji z eksperymentów z ich udziałem jest dla uczniów szczególnie trudna. Przypuszczalnie, zagadnienia te są ćwiczone w niewystarczającym stopniu, a więc nauczyciel rozwiązujący takie zadanie na lekcji powinien się upewnić, czy uczniowie rzeczywiście wszystko zrozumieli.
Utwór jest chroniony prawem autorskim. Zasady i warunki korzystania z niego określa Regulamin Serwisu Bazy Dobrych Praktyk.
"Masz uwagi do treści? Uważasz, że zawiera błąd? Napisz na bnd@ibe.edu.pl





