Wiązka zadań
Właściwości gliceryny
Zadanie
Na lekcji chemii uczeń przygotował trzy probówki z gliceryną i przeprowadził następujące doświadczenie:
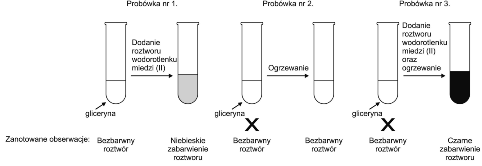
Dla każdego z poniższych stwierdzeń określ, czy jest poprawnym wnioskiem z przedstawionego doświadczenia.
| Stwierdzenie | Czy jest poprawnym wnioskiem? | |
| 1. | Gliceryna zawsze reaguje z wodorotlenkami. | `square` Tak / `square` Nie |
| 2. | Wodorotlenek miedzi(II) ulega reakcji z gliceryną. | `square` Tak / `square` Nie |
| 3. | Czarne zabarwienie w probówce nr 3. powstało w wyniku ogrzewania gliceryny. | `square` Tak / `square` Nie |
Poprawna odpowiedź
1. Nie,
2. Tak,
3. Nie
Wymaganie ogólne
2.1 Rozumowanie i zastosowanie nabytej wiedzy do rozwiązywania problemów. Uczeń opisuje właściwości substancji i wyjaśnia przebieg prostych procesów chemicznych;
3.2 Opanowanie czynności praktycznych. Uczeń projektuje i przeprowadza proste doświadczenia chemiczne.
Wymaganie szczegółowe
9.3 Pochodne węglowodorów. Substancje chemiczne o znaczeniu biologicznym. Uczeń zapisuje wzór sumaryczny i strukturalny glicerolu/ bada i opisuje właściwości glicerolu/ wymienia jego zastosowania.
Komentarz
Prezentowane zadanie zostało opracowane w celu zbadania umiejętności wnioskowania na podstawie obserwacji z przeprowadzonego doświadczenia. Jest to jedna z kluczowych umiejętności związanych z metodą naukową, jakie powinien nabyć uczeń w toku nauczania chemii w gimnazjum. We wstępie do zadania przedstawiono schemat eksperymentu odwołującego się do treści nauczania wymienionych w punkcie 9.3 podstawy programowej: Uczeń (…) bada i opisuje właściwości glicerolu (…). Na schematach pokazano probówki z substratami użytymi w doświadczeniach oraz obserwacje, w których zanotowano wygląd roztworów przed i po reakcji (jeśli zaszła). Uczniowie nie powinni mieć problemów z odczytywaniem tego typu prostych schematów doświadczeń, zwłaszcza że odwołują się one do podpunktu 3.2 wymagań ogólnych podstawy programowej: Uczeń projektuje i przeprowadza proste doświadczenia chemiczne.
Uczeń powinien przeanalizować opis doświadczenia przedstawiony na rysunku, a następnie odpowiedzieć na pytanie, czy na podstawie zanotowanych obserwacji można wyciągnąć wnioski wymienione w tabeli. Pierwsze stwierdzenie dotyczy uogólnienia – uczeń musi zdecydować, czy można wywnioskować, że gliceryna zawsze reaguje z wodorotlenkami jedynie na podstawie reakcji gliceryny z roztworem wodorotlenku miedzi(II). Oczywiście odpowiedź brzmi nie – na podstawie reakcji gliceryny tylko z jednym wodorotlenkiem nie można wysnuć takiego wniosku.
Kolejne stwierdzenie dotyczy reakcji Cu(OH)2 z gliceryną – na podstawie zanotowanych obserwacji oraz zmian w probówkach uczeń musi stwierdzić, czy taka reakcja rzeczywiście zachodzi. Na schemacie pokazano 3 probówki: do probówki nr 2, zawierającej bezbarwną glicerynę, nie dodano roztworu Cu(OH)2, a po podgrzaniu gliceryna pozostała bezbarwna; do gliceryny w probówce nr 1 dodano roztwór Cu(OH)2 i zaobserwowano zmianę barwy na niebieską, a więc zaszła reakcja chemiczna; w przypadku probówki nr 3 otrzymano roztwór o czarnym zabarwieniu – uczeń powinien wywnioskować, że najpierw po zmieszaniu gliceryny z Cu(OH)2 powstał niebieski roztwór, a potem, pod wpływem ogrzewania nastąpiła reakcja, w wyniku której powstał czarny osad. Reakcje, które zaszły w probówkach 1 i 3 są potwierdzeniem stwierdzenia 2 – wodorotlenek miedzi(II) ulega reakcji z gliceryną (doświadczenie w probówce nr 2 pełni rolę próby kontrolnej).
W przypadku stwierdzenia 3 uczeń powinien zauważyć, że doświadczenie z probówką nr 2 jest próbą kontrolną dla doświadczenia z probówką nr 3 – jeśli ogrzewanie czystej gliceryny nie prowadzi do powstania roztworu o czarnym zabarwieniu, to ogrzewanie gliceryny nie może być też przyczyną powstania czarnego osadu w probówce nr 3. Ponadto, czarny osad nie mógł też powstać na skutek zmieszania gliceryny z roztworem Cu(OH)2, ponieważ z obserwacji probówki nr 1 wynika, że roztwór powinien być wtedy niebieski.
Zadanie zbadano na grupie 203 uczniów z klas III gimnazjum. Poniżej przedstawiono wyniki, jakie uzyskali uczniowie rozwiązujący to zadanie.
Tabela 1. Rozkład procentowy odpowiedzi uczniów na pytania postawione w poleceniu do zadania (właściwe odpowiedzi zaznaczono niebieskim drukiem).
| Stwierdzenie | Czy jest poprawnym wnioskiem? | |
| 1. | Gliceryna zawsze reaguje z wodorotlenkami. | `square` Tak (71,4%) / `square` Nie (28,1%) |
| 2. | Wodorotlenek miedzi(II) ulega reakcji z gliceryną. | `square` Tak (84,2%) / `square` Nie (15,8%) |
| 3. | Czarne zabarwienie w probówce nr 3. powstało w wyniku ogrzewania gliceryny. | `square` Tak (54,2%) / `square` Nie (45,3%) |
W sumie całe zadanie poprawnie rozwiązało zaledwie 8,4% uczniów biorących udział w badaniu, a więc zadanie okazało się dla uczniów niezwykle trudne. Uzyskany wynik był niższy nawet od prawdopodobieństwa przypadkowego udzielenia prawidłowej odpowiedzi, wynoszącego 12,5%.
Najsłabsze wyniki uczniowie uzyskali w przypadku stwierdzenia 1 – zaledwie 28% uznało, że nie jest to poprawny wniosek. Niemal trzy czwarte uczniów rozwiązujących to zadanie uznało, że w oparciu o wyniki eksperymentu z pojedynczym wodorotlenkiem można wyciągnąć wniosek dotyczący ogólnej reaktywności gliceryny z wszystkimi wodorotlenkami. Nawet w grupie uczniów, którzy osiągnęli najlepsze wyniki w całym teście, poprawną odpowiedź wskazało niecałe 53% badanych. Przyczyną popełnienia takiego błędu może być sposób realizowania doświadczeń na lekcjach – eksperymenty przeprowadzane w trakcie zajęć są najczęściej ilustracją pewnych ogólnych praw i zjawisk, dlatego też uczniowie mogą mieć tendencję do generalizowania na podstawie pojedynczych doświadczeń. Uczniowie powinni być od początku uczeni, że sformułowanie reguły dotyczącej reaktywności jakiegoś związku często wymaga przeprowadzenia szerokiego spektrum reakcji.
Dużo lepsze wyniki uczniowie uzyskali w przypadku stwierdzenia 2 – ponad 84% poprawnie uznało, że można taki wniosek wysnuć z opisanych w zadaniu doświadczeń. Uczniowie, który wybrali błędną odpowiedź prawdopodobnie nie rozpoznali objawów reakcji w probówkach 1 i 3, choć były one bardzo czytelne, co może świadczyć o poważnych brakach na poziomie podstawowych wiadomości i umiejętności dotyczących rozpoznawania reakcji chemicznych.
W przypadku pytania 3 poprawną odpowiedź wybrało 45,3% uczniów biorących udział w badaniu i tylko w grupie uczniów, którzy uzyskali najwyższe wyniki w całym teście poprawnej odpowiedzi udzieliło 79% badanych. Pozostali mylnie zinterpretowali wyniki doświadczenia w probówce nr 3, gdyż najprawdopodobniej nie zauważyli, że trzeba je porównać z doświadczeniem nr 2, w którym badano wpływ temperatury na czystą glicerynę. Nie można też wykluczyć, że większość uczniów nie potrafiła zidentyfikować substancji, z której powstał czarny osad, ponieważ nie rozumiała, co dokładnie zaszło w trzeciej probówce.
Bardzo niski odsetek uczniów, którzy poprawnie odpowiedzieli na wszystkie trzy pytania sugeruje, że na lekcjach chemii zbyt mało czasu poświęca się na kształtowanie podstawowych umiejętności związanych z metodologią badawczą – poprawnego wyciągania wniosków z zaobserwowanych zjawisk, rozróżniania próby kontrolnej i badawczej, a także analizy wpływu różnych czynników na przebieg doświadczenia. Wyniki badania pokazały także, że nawet najlepsi uczniowie mają tendencję do generalizowania na podstawie pojedynczych doświadczeń i nie wiedzą, kiedy takie wnioskowanie jest uprawnione, a kiedy nie, warto więc rozwiązywać z uczniami więcej zadań, które rozwijają tego typu umiejętności.
Utwór jest chroniony prawem autorskim. Zasady i warunki korzystania z niego określa Regulamin Serwisu Bazy Dobrych Praktyk.
"Masz uwagi do treści? Uważasz, że zawiera błąd? Napisz na bnd@ibe.edu.pl





