Wiązka zadań
Laboratorium w Sendai
Zadanie
|
Film science fiction „Laboratorium w Sendai” przedstawia japońskich chemików z Uniwersytetu Tohoku, którzy otrzymali nowy pierwiastek chemiczny o liczbie atomowej 120 i nadali mu symbol X. Pierwiastek rozpadł się w tak krótkim czasie, że nie zdążyli zbadać jego właściwości. Określ prawdopodobne cechy pierwiastka X zakładając, że posiadałby on właściwości typowe dla grupy pierwiastków, w której leży w układzie okresowym. |
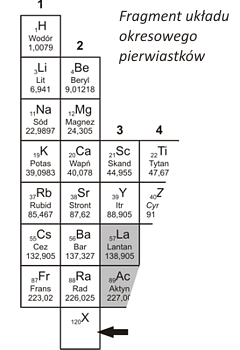 |
| Prawdopodobne cechy pierwiastka | Tak czy nie? |
| 1. Pierwiastek jest niemetalem. | `square` Tak / `square` Nie |
| 2. Pierwiastek szybko reaguje z wodą. | `square` Tak / `square` Nie |
| 3. Pierwiastek reaguje z kwasem solnym. | `square` Tak / `square` Nie |
Poprawna odpowiedź
1. Nie
2. Tak
3. Tak
Wymaganie ogólne
1.1 Pozyskiwanie, przetwarzanie i tworzenie informacji. Uczeń pozyskuje i przetwarza informacje z różnorodnych źródeł z wykorzystaniem technologii informacyjno – komunikacyjnych.
2.1 Rozumowanie i zastosowanie nabytej wiedzy do rozwiązywania problemów. Uczeń opisuje właściwości substancji i wyjaśnia przebieg prostych procesów chemicznych;
Wymaganie szczegółowe
1.5 Substancje i ich właściwości. Uczeń klasyfikuje pierwiastki na metale i niemetale/ odróżnia metale od niemetali na pod stawie ich właściwości.
2.1 Wewnętrzna budowa materii. Uczeń odczytuje z układu okresowego podstawowe informacje o pierwiastkach (symbol, nazwę, liczbę atomową, masę atomową, rodzaj pierwiastka – metal lub niemetal).
2.4 Wewnętrzna budowa materii. Uczeń wyjaśnia związek pomiędzy podobieństwem właściwości pierwiastków zapisanych w tej samej grupie układu okresowego a budową atomów i liczbą elektronów walencyjnych.
7.4 Sole. Uczeń pisze równania reakcji otrzymywania soli (reakcje: kwas + wodorotlenek metalu, kwas + tlenek metalu, kwas + metal, wodorotlenek metalu + tlenek niemetalu).
Komentarz
Prawo okresowości, które sformułował w 1869 roku Mendelejew na podstawie prawa oktaw Newlandsa położyło podwaliny pod całą współczesną chemię. Jak wiadomo, prawo to stwierdza, że właściwości fizykochemiczne pierwiastków zmieniają się w sposób okresowy wraz ze wzrostem liczby atomowej pierwiastka. Pomimo, że od skonstruowania układu okresowego minie niedługo 150 lat, to zarówno sam układ okresowy jak i prawo okresowości są obecnie przyjęte za kamienie milowe tej dziedziny wiedzy. Sama tablica Mendelejewa pozwoliła nie tylko na usystematyzowanie ówczesnej wiedzy, ale również na przewidywanie właściwości nieznanych jeszcze wtedy pierwiastków.
Pierwszy sztuczny pierwiastek (pierwszy transuranowiec, czyli pierwiastek leżący za uranem w układzie okresowym) – neptun – odkryto w 1940 roku. Postęp chemii doprowadził w kolejnych dziesięcioleciach do wytworzenia kolejnych pierwiastków otrzymywanych sztucznie. Każdy z nich, po wstępnych badaniach można było zaszeregować w odpowiednim miejscu układu okresowego. W miarę jak rosły masy atomowe i liczby atomowe nowo otrzymanych pierwiastków, badanie ich właściwości fizykochemicznych napotykało na coraz większe trudności ze względu na coraz mniejsze liczby atomów, jakie udawało się uzyskać w trakcie eksperymentów. Przykładowo, po raz pierwszy otrzymano sztucznie jedynie 17 atomów pierwiastka 101 – mendelewu, nazwanego tak dla uczczenia zasług wielkiego rosyjskiego naukowca. Pierwiastki 105, 106 oraz 107 udało się uzyskać jedynie w postaci pojedynczych atomów, ale mimo wszystko, dzięki samej liczbie atomowej naukowcy mogą przewidywać ich właściwości fizykochemiczne właśnie dzięki posługiwaniu się prawem okresowości.
Prawo okresowości oraz układ okresowy mogą być szczególnie pomocne początkującym naukowcom (również tym przyszłym), dzięki ich zastosowaniu mogą oni bowiem wywnioskować bardzo wiele na temat zarówno struktury atomu, właściwości fizycznych i reaktywności chemicznej samych pierwiastków, jak i tworzonych przez nie związków chemicznych.
Przedstawione zadanie dotyczy problemu odkrycia nowego pierwiastka, który jest na tyle niestabilny, że nie można było określić jego właściwości. Jedyne informacje, jakie dostaje uczeń, to jego położenie w układzie okresowym oraz wartość liczby atomowej Z, równa 120. Funkcją zadania jest weryfikacja umiejętności odczytywania właściwości pierwiastków, a pośrednio i niektórych związków chemicznych, z układu okresowego. Zadanie jest złożone. Aby prawidłowo rozwiązać problem, uczeń powinien:
- zauważyć, że pierwiastek „X” leży w grupie metali (punkty 2.1, 2.4),
- wiedzieć, że aktywność metali należących do tej samej grupy zwiększa się w miarę wzrostu liczby atomowej, oraz uznać, że pierwiastek „X” byłby najbardziej aktywnym metalem tej grupy (2.4),
- przypomnieć sobie, jakie typowe właściwości mają metale (1.5),
- wiedzieć, jak aktywny metal zachowuje się w kontakcie z wodą i kwasami (7.4).
Pierwszy wiersz tabeli dotyczy jednej z najbardziej podstawowych cech substancji prostych, z jakimi uczeń ma do czynienia na lekcjach chemii - odróżniania metali od niemetali. W drugim wierszu tabeli, zaprojektowanym jako najtrudniejszy w zadaniu, celowo pytamy o szybkość reakcji z wodą. Aktywne metale reagują z wodą bardzo intensywnie, a nawet się w niej zapalają (potas), czy eksplodują już pod wpływem nawet niewielkich ilości wilgoci (na przykład cez) – dlatego uczeń musi odróżniać taką reakcję od spokojnej, długotrwałej reakcji metalu z wodą jaką jest przykładowo korozja. Trzeci wiersz tabeli dotyczy typowych właściwości chemicznych pierwiastka. W wierszu tym został wybrany kwas, który uczniowie powinni znać z lekcji, a więc pojawienie się jego w zadaniu nie powinno dla nich stanowić dodatkowej przeszkody.
W zadaniu celowo założono, że uczeń ma przewidzieć właściwości pierwiastka, który nie został jeszcze odkryty. Zastosowanie pierwiastka znanego dawałoby szanse na sukces w tym zadaniu uczniom, którzy jedynie pamięciowo opanowali właściwości pierwiastków, a nie potrafią korzystać ze źródła wiedzy jakim jest układ okresowy.
Utwór jest chroniony prawem autorskim. Zasady i warunki korzystania z niego określa Regulamin Serwisu Bazy Dobrych Praktyk.
"Masz uwagi do treści? Uważasz, że zawiera błąd? Napisz na bnd@ibe.edu.pl





