Wiązka zadań
Właściwości pierwiastka a jego położenie w układzie okresowym
Zadanie wraz z komentarzem pochodzi z publikacji:
Ostrowska B., Spalik K., red., 2010, Umiejętności złożone w nauczaniu historii i przedmiotów przyrodniczych. Warszawa: Wydawnictwo Instytutu Filozofiii i Socjologii PAN.
Publikacja jest pokłosiem projektu badawczego finansowanego przez Centralną Komisję Egzaminacyjną oraz Europejski Fundusz Społeczny.
Zadanie
Na schemacie układu okresowego zaznaczono położenie siedmiu pierwiastków (A-G).
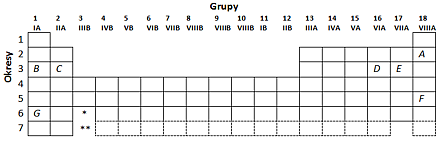
Które z podanych poniżej cech (1-6) wykazuje każdy z tych pierwiastków? Zaznacz odpowiedź, wstawiając X w odpowiednie miejsce tabeli.
- Ten pierwiastek leży w drugim okresie układu okresowego.
- Atom tego pierwiastka ma 6 elektronów walencyjnych.
- Ten pierwiastek jest niemetalem.
- Jądro atomowe tego pierwiastka ma 10 protonów.
- Ten pierwiastek jest zawsze jednowartościowy.
- Ten pierwiastek dobrze przewodzi ciepło i prąd elektryczny.
| Pierwiastek | Cecha | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| A | ||||||
| B | ||||||
| C | ||||||
| D | ||||||
| E | ||||||
| F | ||||||
| G | ||||||
Poprawna odpowiedź
A – 1, 3, 4
B – 5, 6
C – 6
D – 2, 3
E – 3
F – 3
G – 5, 6
Wymaganie ogólne
1.1 Pozyskiwanie, przetwarzanie i tworzenie informacji. Uczeń pozyskuje i przetwarza informacje z różnorodnych źródeł z wykorzystaniem technologii informacyjno – komunikacyjnych.
Wymaganie szczegółowe
1.5 Substancje i ich właściwości. Uczeń klasyfikuje pierwiastki na metale i niemetale/ odróżnia metale od niemetali na pod stawie ich właściwości.
2.1 Wewnętrzna budowa materii. Uczeń odczytuje z układu okresowego podstawowe informacje o pierwiastkach (symbol, nazwę, liczbę atomową, masę atomową, rodzaj pierwiastka – metal lub niemetal).
2.2 Wewnętrzna budowa materii. Uczeń opisuje i charakteryzuje skład atomu (jądro: protony i neutrony, elektrony)/ definiuje elektrony walencyjne.
2.3 Wewnętrzna budowa materii. Uczeń ustala liczbę protonów, elektronów i neutronów w atomie danego pierwiastka, gdy dana jest liczba atomowa i masowa.
2.4 Wewnętrzna budowa materii. Uczeń wyjaśnia związek pomiędzy podobieństwem właściwości pierwiastków zapisanych w tej samej grupie układu okresowego a budową atomów i liczbą elektronów walencyjnych.
2.10 Wewnętrzna budowa materii. Uczeń definiuje pojęcie jonów i opisuje, jak powstają/ zapisuje elektronowo mechanizm powstawania jonów, na przykładzie Na, Mg, Al, Cl, S/ opisuje powstawanie wiązania jonowego.
2.12 Wewnętrzna budowa materii. Uczeń definiuje pojęcie wartościowości jako liczby wiązań, które tworzy atom, łącząc się z atomami innych pierwiastków/ odczytuje z układu okresowego wartościowość maksymalną dla pierwiastków grup: 1., 2., 13., 14., 15., 16. i 17. (względem tlenu i wodoru).
Komentarz
Odkrycie budowy atomu i usystematyzowanie wiedzy na temat pierwiastków chemicznych to jedne z najważniejszych osiągnięć nauki. Układ okresowy jest dla chemika punktem wyjścia do rozważań na temat materii. Porządkuje tę dziedzinę wiedzy i ujmuje ją w ścisłe ramy. Umiejętność korzystania z układu zapisana jest milcząco w wymaganiach ogólnych w punkcie I i w czterech punktach wymagań szczegółowych wprost (2.1; 2.4; 2.12; i 4.2). Można zaryzykować stwierdzenie, że odczytywanie informacji z układu okresowego, ich analiza i interpretacja są jednymi z najważniejszych umiejętności, jakie uczeń powinien wynieść z kursu chemii. Nie powinno to jednak być mechaniczne wyszukiwanie informacji; najlepiej byłoby, gdyby uczeń znał konstrukcję układu i rozumiał zasadę, na jakiej opiera się uporządkowanie w niej pierwiastków chemicznych, i z tego właśnie czerpał wiedzę o budowie materii. Wszystko bowiem zależy od stopnia szczegółowości opisu układu okresowego. Jeżeli wszystkie właściwości obiektów są podane wprost, to korzystanie z niego będzie czysto mechaniczne. Inaczej wygląda sytuacja przedstawiona w omawianym zadaniu. Na ilustracji podano bowiem jedynie zarys układu wraz z oznaczeniem okresów i grup. Nie ma na nim symboli pierwiastków chemicznych, które w tym przypadku mogłyby stanowić nieocenioną podpowiedź dla ucznia. Wtedy jednakże zadanie mogłoby się sprowadzać jedynie do pamięciowego odtwarzania informacji nabytych w szkole o właściwościach konkretnych pierwiastków chemicznych, co oczywiście nie było celem autorów. Zadanie pokazuje, czy uczeń jest na tyle obyty z układem okresowym, żeby swobodnie z niego korzystać, nawet gdy zawarto na nim jedynie szczątkowe informacje. Sposób wykonania polecenia jest następujący: uczeń przyporządkowuje podane właściwości pierwiastka lub jego atomu (1–6) do kilku pierwiastków oznaczonych literami A–G w układzie okresowym. Aby prawidłowo odpowiedzieć na to pytanie, uczeń powinien: znać budowę układu okresowego (wszystkie cechy), wiedzieć, w którym miejscu w układzie okresowym znajdują się metale i niemetale oraz znać właściwości tych ostatnich (cechy 3 i 6), znać podstawowe pojęcia związane z budową atomu takie jak: powłoka walencyjna, jądro, proton, i umieć określać wartościowość, liczbę protonów, elektronów i elektronów walencyjnych na podstawie położenia pierwiastka w układzie okresowym (cechy 2, 4, i 5). Zidentyfikowanie pierwiastka A jako leżącego w drugim okresie (cecha 1) świadczy o tym, że uczeń zna budowę układu okresowego. Przypisanie pierwiastkom cechy trzeciej powinno być spójne z cechą szóstą – dopiero wtedy sprawdzimy, czy uczeń rozróżnia metale i niemetale. Właściwe określenie cech drugiej i czwartej sprawdza znajomość związku pomiędzy budową atomu a położeniem pierwiastka w układzie okresowym, a cechy piątej – czy uczeń umie powiązać położenie pierwiastka chemicznego z jego maksymalną wartościowością w związkach chemicznych. Przedstawione tu zadanie jest dość złożone i pokazuje, jak wiele różnych właściwości pierwiastków można w ten sposób sprawdzać. Na sprawdzianie lub egzaminie należy ograniczyć liczbę cech i pierwiastków.
Utwór jest chroniony prawem autorskim. Zasady i warunki korzystania z niego określa Regulamin Serwisu Bazy Dobrych Praktyk.
"Masz uwagi do treści? Uważasz, że zawiera błąd? Napisz na bnd@ibe.edu.pl





