Wiązka zadań
Spiralny układ okresowy
Zadanie
W zadaniu przedstawiono dwie wersje układu okresowego: tradycyjny układ okresowy, a pod nim jego spiralną wersję. Spiralny układ okresowy zorganizowany jest na nieco innych zasadach niż jego tradycyjna wersja.
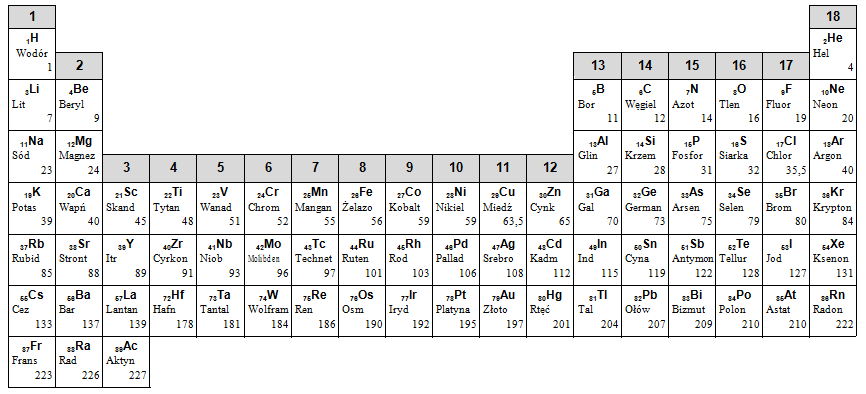
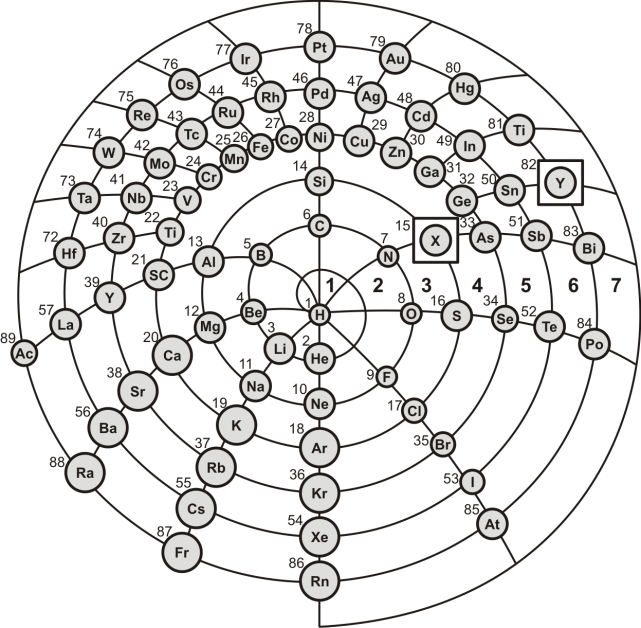
Źródło rysunku (Zmodyfikowany) http://www.meta-synthesis.com/webbook/35_pt/600px-Periodic_table_(spiral_format).SVG-1.png, zmodyfikowany
Na układzie spiralnym liczbę zwojów spirali oznaczono numerami od 1 do 7.
Oceń, które stwierdzenia są fałszywe, a które prawdziwe.
| Lp. | Stwierdzenie | Prawda czy fałsz? |
| I. | Pierwiastek oznaczony jako Y położony jest w 16 grupie układu okresowego. | `square` prawda / `square` fałsz |
| II. | Pierwiastek oznaczony symbolem X to fosfor. | `square` prawda / `square` fałsz |
| III. | Numer zwoju spirali odzwierciedla liczbę powłok elektronowych w atomach pierwiastków. | `square` prawda / `square` fałsz |
Poprawna odpowiedź
I. fałsz, II. prawda, III. prawda
Wymaganie ogólne
1.1 Pozyskiwanie, przetwarzanie i tworzenie informacji. Uczeń pozyskuje i przetwarza informacje z różnorodnych źródeł z wykorzystaniem technologii informacyjno – komunikacyjnych.
Wymaganie szczegółowe
2.1 Wewnętrzna budowa materii. Uczeń odczytuje z układu okresowego podstawowe informacje o pierwiastkach (symbol, nazwę, liczbę atomową, masę atomową, rodzaj pierwiastka – metal lub niemetal).
2.4 Wewnętrzna budowa materii. Uczeń wyjaśnia związek pomiędzy podobieństwem właściwości pierwiastków zapisanych w tej samej grupie układu okresowego a budową atomów i liczbą elektronów walencyjnych.
2.10 Wewnętrzna budowa materii. Uczeń definiuje pojęcie jonów i opisuje, jak powstają/ zapisuje elektronowo mechanizm powstawania jonów, na przykładzie Na, Mg, Al, Cl, S/ opisuje powstawanie wiązania jonowego.
Komentarz
Światowej sławy chemik, Peter Wiliam Atkins, wyróżnił dziewięć filarów wykształcenia chemicznego każdego dorosłego człowieka. Pierwszym z tych filarów jest według niego wiedza o ziarnistej budowie materii. Jako drugi filar Atkins wymienił świadomość tego, że pierwiastki można zgrupować w rodziny, których właściwości są podobne i mogą być zrozumiane w kontekście poznania struktury atomu. Kluczem do odczytania struktury dowolnego atomu, jak i zrozumienia periodyczności we właściwościach pierwiastków wraz z ich rosnącą liczbą atomową, jest układ okresowy. Umiejętność odczytywania informacji z układu okresowego jest, więc jedną z podstawowych umiejętności, jakie należy kształtować na lekcjach chemii, ponieważ jest w nich zakodowane niezwykle istotne przesłanie. Świadomie nimi operując, uczniowie mogą wnioskować z układu okresowego wiele danych na temat struktury atomów jak i ich reaktywności Należy jednak zadbać o to, aby odczytywanie informacji z układu okresowego nie było jedynie mechaniczną czynnością powtarzania pewnego systemu liter cyfr i nazw, jak numer grupy, numer okresu, czy liczba atomowa.
Zaproponowane zadanie można wykorzystać na lekcji powtórzeniowej dotyczącej układu okresowego. Pokazanie innej formy graficznej układu może sprzyjać utrwaleniu informacji go dotyczących, a także sprawnego posługiwania się nabytą wiedzą w nowej sytuacji. Przełożenie jednej formy zapisu układu okresowego na drugą wymaga pewnej wyobraźni przestrzennej i myślenia abstrakcyjnego. Pomimo tego jednak uczeń, który dobrze opanował podstawy budowy układu okresowego, nie powinien mieć bardzo dużych trudności ze zrozumieniem tej formy jego zapisu, ponieważ zasada budowy tego układu jest analogiczna do zastosowanej w tradycyjnym ujęciu układu okresowego – pierwiastki są wymienione w kolejności ich rosnących liczb atomowych, z tą różnicą, że zamiast układać się w rzędy, tworzą spiralę. Uczeń może sam dokonać tego odkrycia i uświadomić sobie wspomnianą prawidłowość, porównując oba układy, a nawet spróbować zaproponować inne rozwiązania graficzne, które mogłyby być zastosowane do stworzenia alternatywnej formy układu okresowego.
Aby prawidłowo rozwiązać zadanie, uczeń powinien:
- znać budowę tradycyjnego układu okresowego oraz wiedzieć, że wyróżniamy w nim pionowe kolumny, czyli grupy, oraz poziome rzędy – okresy (stwierdzenia: 1 oraz 3),
- zauważyć analogię miedzy obydwoma układami, zrozumieć, że układ spiralny jest zbudowany na takiej samej zasadzie jak tradycyjny układ okresowy, oraz opisać układ spiralny – ustalić, co jest odpowiednikiem grupy i okresu w odniesieniu do tradycyjnej formy zapisu układu (wszystkie stwierdzenia),
- wiedzieć, że w numerze grupy zakodowana jest informacja na temat liczby elektronów walencyjnych rozważanego pierwiastka (stwierdzenie 3), a z liczbą powłok elektronowych związany jest numer okresu, w którym leży pierwiastek.
Trudno oceniać wyżej wymienione umiejętności osobno – zadanie należy oceniać całościowo – dopiero prawidłowa odpowiedź na wszystkie trzy stwierdzenia z tabeli świadczy o tym, że uczeń potrafi korzystać z układu okresowego.
Stwierdzenia 1 i 2 sprawdzają czy uczeń zauważył analogię między obydwoma układami. Jeżeli odpowie on poprawnie tylko na jeden z tych wierszy oznacza to, że odpowiedź jest przypadkowa. Wiersz III dotyczy powiązania liczby elektronów walencyjnych i powłok elektronowych pierwiastków z położeniem ich w układzie okresowym. Jeżeli uczeń odpowie poprawnie na wszystkie trzy stwierdzenia, możemy uznać, że ma umiejętność odczytywania informacji dotyczących budowy atomów pierwiastków z układu okresowego.
Przedstawione zadanie pokazuje, jak w czasie lekcji powtórzeniowej można „wyjść ze schematu” i w alternatywny sposób sprawdzić umiejętność posługiwania się układem okresowym pierwiastków chemicznych.
Utwór jest chroniony prawem autorskim. Zasady i warunki korzystania z niego określa Regulamin Serwisu Bazy Dobrych Praktyk.
"Masz uwagi do treści? Uważasz, że zawiera błąd? Napisz na bnd@ibe.edu.pl





