Wiązka zadań
Hodowla kryształów soli na ziarnie fasoli
Celem doświadczenia było otrzymanie kryształków chlorku potasu na ziarnie fasoli. W tym celu do naczynia wlano nasycony roztwór chlorku potasu, a następnie położono na naczyniu patyk z przywiązaną do niego nicią. Na jej końcu zawieszone było suche ziarno fasoli. Po pewnym czasie wokół ziarna fasoli utworzyły się kryształki chlorku potasu.
Doświadczenie wykonano w temperaturze pokojowej.
Rozpuszczalność chlorku potasu rośnie wraz ze wzrostem temperatury.
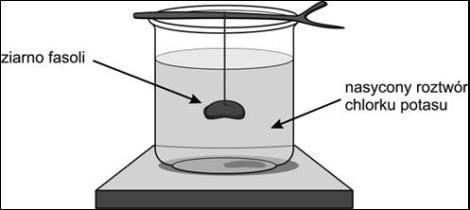
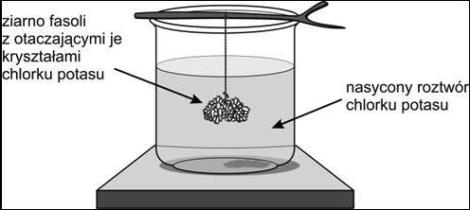
Źródło: „Między zabawą a chemią” Żivko K. Kostić
Zadanie 1
Dysponując maksymalnie 75 g każdej soli z wymienionych w tabeli oraz wykorzystując 200 g wody, zdecyduj której z nich można użyć w doświadczeniu zamiast chlorku potasu, aby w temperaturze 20oC uzyskać roztwór nasycony?
| Wzór soli |
Rozpuszczalność (ilość g soli w 100 g wody w temp. 20°C) |
| KNO3 | 31,9 |
| NaNO3 | 87,2 |
| NaCl | 35,9 |
Poprawna odpowiedź
1 - tak
2 - nie
3 - tak
Wymaganie ogólne
2.1 Rozumowanie i zastosowanie nabytej wiedzy do rozwiązywania problemów. Uczeń opisuje właściwości substancji i wyjaśnia przebieg prostych procesów chemicznych;
2.3 Rozumowanie i zastosowanie nabytej wiedzy do rozwiązywania problemów. Uczeń wykonuje proste obliczenia dotyczące praw chemicznych.
Wymaganie szczegółowe
5.4 Woda i roztwory wodne. Uczeń opisuje różnice pomiędzy roztworem rozcieńczonym, stężonym, nasyconym i nienasyconym.
5.5 Woda i roztwory wodne. Uczeń odczytuje rozpuszczalność substancji z wykresu jej rozpuszczalności.
Komentarz
We wstępie do zadania opisano doświadczenie, w którym można otrzymać kryształy chlorku potasu na ziarnie fasoli. Siłą napędową procesu krystalizacji soli jest przesycenie roztworu, do którego dochodzi po częściowym odparowaniu wody w temperaturze pokojowej z nasyconego roztworu soli. Aby ułatwić proces krystalizacji do roztworu włożono ziarno fasoli, którego powierzchnia może pełnić funkcję zarodków krystalizacji. Na dołączonym do wstępu schemacie pokazano ilość wody w otwartym naczyniu na początku doświadczenia oraz po upływie pewnego czasu, kiedy wytrąciły się już na ziarnie fasoli kryształki soli. Mniej uważny uczeń może mieć trudności z dostrzeżeniem ubytku wody z naczynia. W dalszej części zadania 1 umieszczono informację niezbędną do jego rozwiązania: podano rozpuszczalność wybranych soli w temperaturze 20°C. Uczeń ma ocenić, czy 75 g danej soli wystarczy do sporządzenia nasyconego roztworu w 200 g wody w temperaturze 20°C. Aby dobrze rozwiązać to zadanie, uczeń powinien rozumieć pojęcia: roztwór nasycony, roztwór nienasycony, rozpuszczalność oraz umieć obliczyć maksymalną ilość substancji, jaką można rozpuścić w określonej masie wody, aby otrzymać roztwór nasycony. W celu rozwiązania zadania uczeń powinien zauważyć, że w tabeli podano rozpuszczalność soli w 100 g wody, a jemu jest potrzebna rozpuszczalność dla 200 g wody. Następnie należy oszacować (lub obliczyć), jaką masę każdej soli można rozpuścić w 200 g wody oraz porównać otrzymany wynik z wartością 75 g. Jeśli obliczona masa soli jest mniejsza niż 75 g, to możliwe jest uzyskanie nasyconego roztworu danej soli, jeśli zaś jest większa, to nie będzie to możliwe. Warto zauważyć, że azotan sodu można wyeliminować już na wstępie, gdyż rozpuszczalność tej soli w 100 g wody (87,2 g) przekracza znacznie narzuconą w zadaniu masę 75 g. Uczniowi pozostaje więc sprawdzenie czy rozpuszczalność azotanu potasu i chlorku sodu w dwukrotnie większej objętości wody będzie większa niż 75 g.
Jak odpowiadali uczniowie
Badaniem objęto 165 uczniów trzeciej klasy gimnazjum. W poniższej tabeli przedstawiono rozkład procentowy ich odpowiedzi (pogrubioną czcionką oznaczono odpowiedź poprawną).
| Wzór soli |
Rozpuszczalność (ilość g soli w 100 g wody w temp. 20°C) |
| KNO3 | tak (63,6%) / nie (33,9%) |
| NaNO3 | tak (37,7%) / nie (61,9%) |
| NaCl | tak (61,9%) / nie (35,7%) |
Zadanie okazało się dosyć trudne dla uczniów. Tylko 41% badanych udzieliło prawidłowej odpowiedzi na wszystkie 3 pytania. Nie różnicowało ono też uczniów pod względem umiejętności, gdyż liczba odpowiedzi poprawnych była w poszczególnych grupach uczniów, uporządkowanych według liczby punktów uzyskanych w całym teście, dość podobna.
Poza niewystarczającą znajomością procesu krystalizacji oraz pojęć takich jak: rozpuszczalność, roztwór nasycony czy roztwór nienasycony, przyczyną błędnych odpowiedzi uczniów mogły być trudności ze zrozumieniem polecenia. Jego druga część: (…) zdecyduj, której z nich można użyć w doświadczeniu zamiast chlorku potasu, aby w temperaturze 20°C uzyskać roztwór nasycony, mogła być dla uczniów myląca, jeśli nie zauważyli, że pytanie dotyczy otrzymywania roztworu nasyconego soli, a nie tego, czy w ogóle będzie możliwe uzyskanie kryształów danej soli po odpowiednio długim czasie. W tym drugim przypadku kryształki soli tworzyłyby się w miarę powolnego odparowywania wody z otwartego naczynia, nawet gdyby roztwór soli był początkowo nienasycony. Niektórzy uczniowie mogli także przypuszczać, że wody do sporządzenia roztworu – tak jak i soli – można wykorzystać mniej niż w ilości podanej w zadaniu. Jeśli uczeń założył, że do sporządzenia nasyconego roztworu nie trzeba użyć równo 200 g wody, to takie rozumowanie mogło go doprowadzić do niewłaściwych wniosków.
Ze względu na specyficzne trudności, jakie to zadanie może stwarzać uczniom, nadaje się ono raczej do pracy na lekcji omawiającej temat związany z rozpuszczalnością. Przy okazji nauczyciel może omówić z uczniami takie kwestie, jak różnice pomiędzy krystalizacją a hodowlą kryształów. Prawidłowo wykonana krystalizacja służy bowiem oczyszczaniu substancji i różni się nieco od hodowli kryształów, którą często określa się tym samym mianem.
Proponowane sposoby modyfikacji:
1. Zapytać ucznia, czy w przypadku konkretnej substancji, w której nasycony (lub nienasycony) w 100°C roztwór ochłodzono do podanej temperatury niższej (w zamkniętym naczyniu), można spodziewać się kryształków na fasoli. Oczywiście należy pamiętać, że, niestety, tylko niektóre z soli można do tego użyć (solą, która łatwo krystalizuje jest np. azotan(V) potasu).
2. Przedstawić dwa podobne naczynia (zestawy) z taką samą ilością roztworu soli o identycznym stężeniu, w określonej temperaturze, z tym, że jedno z nich będzie szczelnie zamknięte (podkreślić trzeba niemożliwość ucieczki wody), drugie otwarte i zapytać ucznia o zjawiska, które będzie można zaobserwować, np. w którym naczyniu będzie możliwe uzyskanie kryształków soli i dlaczego.
3. Połączyć powyższe propozycje i przedstawić 2, 3 albo i 4 uczniów, którzy przeprowadzili różne warianty doświadczenia na identycznym zestawie z fasolą. Opisać warunki początkowe prowadzonego eksperymentu. Zapytać, który z uczniów otrzyma kryształy soli i dlaczego.
|
Uczeń 1 |
Uczeń 2 |
Uczeń 3 |
Uczeń 4 |
|
| roztwór użyty w doświadczeniu | nasycony w temperaturze 100°C w zamkniętym naczyniu | nasycony w temperaturze 20°C w zamkniętym naczyniu | nasycony w temperaturze 20°C w otwartym naczyniu | nasycony w temperaturze 100°C w otwartym naczyniu |
| temperatura, w której prowadzono doświadczenie | 20 st. C | |||
Zadanie 2
Które czynności spowolnią, a które przyspieszą proces powstawania kryształów chlorku potasu na ziarnie fasoli?
| Czynność | Spowolni czy przyspieszy? | |
| 1. | Dolanie wody do naczynia. | `square` spowolni / `square` przyspieszy |
| 2. | Przykrycie naczynia. | `square` spowolni / `square` przyspieszy |
| 3. | Postawienie na parapecie w promieniach słonecznych. | `square` spowolni / `square` przyspieszy |
Poprawna odpowiedź
1 - Spowolni
2 - Spowolni
3 - Przyspieszy
Wymaganie ogólne
2.1 Rozumowanie i zastosowanie nabytej wiedzy do rozwiązywania problemów. Uczeń opisuje właściwości substancji i wyjaśnia przebieg prostych procesów chemicznych;
Wymaganie szczegółowe
5.3 Woda i roztwory wodne. Uczeń planuje i wykonuje doświadczenia wykazujące wpływ różnych czynników na szybkość rozpuszczania substancji stałych w wodzie.
5.4 Woda i roztwory wodne. Uczeń opisuje różnice pomiędzy roztworem rozcieńczonym, stężonym, nasyconym i nienasyconym.
Komentarz
Umiejętnością mierzoną w tym zadaniu jest planowanie eksperymentu badającego wpływ różnych czynników na powstawanie kryształków soli na fasoli. Do rozwiązania zadania konieczne jest zrozumienie, na czym polega proces odparowywania substancji, z którym uczniowie powinni się byli już zapoznać na II etapie edukacyjnym, gdyż jest on wymieniony w następującym podpunkcie podstawy programowej dla IV-VI klasy szkoły podstawowej: 14.4. Przemiany substancji. Uczeń: podaje i bada doświadczalnie czynniki wywołujące (…) parowanie (temperatura, ruch powietrza, rodzaj cieczy, wielkość powierzchni). Temat ten jest omawiany także na III etapie edukacyjnym na fizyce: 2.9 Energia. Uczeń opisuje zjawiska (…) parowania (…). Oczywiście uczeń powinien także rozumieć, na czym polega proces krystalizacji kryształków soli z roztworu, rozcieńczanie/zatężanie roztworu i jakie czynniki mogą wpływać na te procesy.
Aby poprawnie rozwiązać to zadanie, uczeń powinien:
- wiedzieć, że proces krystalizacji soli jest zależny od przesycenia roztworu i zachodzi po częściowym odparowaniu wody w temperaturze pokojowej z nasyconego roztworu soli, a zatem wytrącanie kryształków soli zależy od stężenia roztworu (im większe stężenie roztworu, tym szybciej kryształki soli się wytrącają, a im mniejsze – tym wolniej);
- wiedzieć, w jaki sposób stężenie roztworu zależy od masy rozpuszczalnika (w tym przypadku wody) i masy substancji rozpuszczonej (tutaj chlorku potasu), a następnie wywnioskować, że dolanie wody do roztworu spowoduje rozcieńczenie roztworu, a więc stężenie roztworu zmniejszy się i proces wytrącania kryształków soli będzie trwał dłużej;
- zauważyć, że przykrycie naczynia uniemożliwi w dużym stopniu odparowywanie wody z naczynia, a więc roztwór nie osiągnie tym sposobem przesycenia niezbędnego do wytrącenia kryształków soli – proces powstawania kryształów spowolni się;
- zauważyć, że postawienie naczynia w promieniach słonecznych spowoduje ogrzanie roztworu, a to z kolei ułatwi odparowanie wody z roztworu, a zatem proces wytrącania kryształków będzie zachodził szybciej.
Jak odpowiadali uczniowie
Zadanie zostało zbadane na grupie 183 uczniów z klas III gimnazjum. W poniższej tabeli przedstawiono rozkład procentowy odpowiedzi uczniów na pytania postawione w poleceniu do zadania (właściwe odpowiedzi zaznaczono pogrubioną czcionką):
| Czynność | Spowolni czy przyspieszy? | |
| 1. | Dolanie wody do naczynia. | spowolni (55,2%) / przyspieszy (42,1%) |
| 2. | Przykrycie naczynia. | spowolni (47,5%) / przyspieszy (48,6%) |
| 3. | Postawienie na parapecie w promieniach słonecznych. | spowolni (42,1%) / przyspieszy (56,3%) |
Zadanie okazało się dla uczniów bardzo trudne – całe zadanie poprawnie rozwiązało 17,5% uczniów biorących udział w badaniu, a więc niewiele więcej niż wynosiłby wynik uzyskany drogą losową (12,5%). W przypadku pierwszego pytania nieco ponad 55% uczniów odpowiedziało poprawnie, a wyniki badania wskazują, że większość z nich mogła strzelać. Tylko uczniowie, którzy uzyskali najwyższe wyniki z całego testu rozwiązali tę część zadania trochę lepiej. Jeszcze gorzej uczniowie wypadli w przypadku 2 pytania – wybierali błędną odpowiedź lub strzelali. Mogło to wynikać ze słabego zrozumienia, jak ważne dla procesu wytrącania kryształów jest odparowanie rozpuszczalnika. Niewiele lepiej wypadło pytanie 3 – ponad 56% uczniów wskazało odpowiedź poprawną, a tylko wśród uczniów, którzy osiągnęli najlepsze wyniki przeważały odpowiedzi poprawne. Ogólnie zadanie słabo różnicowało uczniów pod względem badanej umiejętności. Brak różnicowania i rozkład zbliżony do losowego zarówno w poszczególnych częściach, jak i dla całości sugerują, że zdecydowana większość uczniów zupełnie nie umiała rozwiązać tego zadania. Wskazuje to na słabe zrozumienie takich kwestii, jak odparowanie i rozcieńczanie roztworów oraz wpływ różnych czynników na te procesy.
Ze względu na trudność zadania, zalecaną formą jego wykorzystania jest przede wszystkim praca na lekcji, gdyż tylko wtedy nauczyciel może omówić z uczniami wszystkie istotne kwestie, wyłapać, czego nie rozumieją, i wyjaśnić wszelkie niejasności.
Utwór jest chroniony prawem autorskim. Zasady i warunki korzystania z niego określa Regulamin Serwisu Bazy Dobrych Praktyk.
"Masz uwagi do treści? Uważasz, że zawiera błąd? Napisz na bnd@ibe.edu.pl





