Wiązka zadań
Otrzymanie kwasu siarkowego(IV) i (VI) – typy reakcji
Zadanie
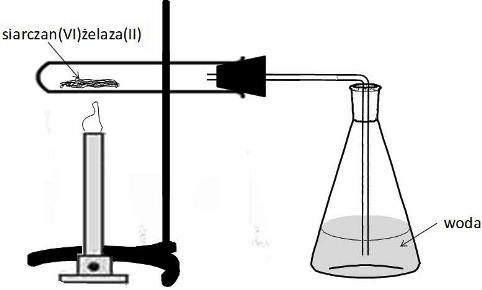
Na rysunku poniżej przedstawiono unowocześniony zestaw do otrzymywania kwasu siarkowego(IV) i (VI) metodą znaną już alchemikom.
Siarczan(VI) żelaza(II) umieszcza się w probówce z trudno topliwego szkła i podgrzewa. Powstałe gazy są doprowadzane za pomocą rurki szklanej do kolby z wodą.
Podczas doświadczenia zachodzą następujące reakcje:
2 FeSO4 → Fe2O3 + SO2 + SO3
SO3 + H2O → H2SO4
SO2 + H2O → H2SO3
Zaklasyfikuj każde z równań reakcji zachodzących w doświadczeniu do odpowiedniego z typów reakcji wymienionych w tabeli.
| Równanie reakcji | Typ reakcji | |
| 1. | 2 FeSO4 → Fe2O3 + SO2 + SO3 |
`square` syntezy `square` analizy |
| 2. | SO3 + H2O → H2SO4 |
`square` syntezy `square` analizy `square` wymiany |
| 3. | SO2 + H2O → H2SO3 |
`square` syntezy `square` analizy `square` wymiany |
Poprawna odpowiedź
1. - analizy
2. - syntezy
3. - syntezy
Wymaganie ogólne
2.1 Rozumowanie i zastosowanie nabytej wiedzy do rozwiązywania problemów. Uczeń opisuje właściwości substancji i wyjaśnia przebieg prostych procesów chemicznych;
Wymaganie szczegółowe
3.2 Reakcje chemiczne. Uczeń opisuje, na czym polega reakcja syntezy, analizy i wymiany/ podaje przykłady różnych typów reakcji i zapisuje odpowiednie równania/ wskazuje substraty i produkty/ dobiera współczynniki w równaniach reakcji chemicznych/ obserwuje doświadczenia ilustrujące typy reakcji i formułuje wnioski.
6.3 Kwasy i zasady. Uczeń planuje i/lub wykonuje doświadczenia, w wyniku których można otrzymać wodorotlenek, kwas beztlenowy i tlenowy (np. NaOH, Ca(OH)2, Al(OH)3, HCl, H2SO3)/ zapisuje odpowiednie równania reakcji.
Komentarz
W zadaniu opisano doświadczenie i przedstawiono zachodzące podczas niego trzy reakcje. Uczeń na podstawie równań reakcji ma zaklasyfikować te przemiany do odpowiedniego typu reakcji. Aby dobrze rozwiązać zadania, niezbędna jest wiedza na temat ogólnego przebiegu reakcji analizy, syntezy i wymiany. W pierwszym równaniu reakcji z jednego substratu powstają trzy produkty. Zgodnie z definicją, ten typ reakcji nazywany jest analizą. Równania reakcji w punkcie 2 i 3 opisują przemianę, w której z dwóch substratów powstaje jeden produkt. Są przykładami reakcji syntezy.
Nieznajomość i/lub niezrozumienie któregokolwiek z terminów: reakcja analizy, reakcja syntezy czy reakcja wymiany, nie pozwala na prawidłowe rozwiązanie zadania.
Jak odpowiadali uczniowie
W badaniu wzięło udział 195 uczniów z klas III gimnazjum. Zadanie okazało się dla uczniów trudne, gdyż właściwej odpowiedzi udzieliło tylko 24,6% badanych. W poniższej tabeli przedstawiono rozkład procentowy odpowiedzi uczniów (pogrubioną czcionką oznaczono odpowiedź poprawną).
| Równanie reakcji | Typ reakcji | |
| 1. | 2 FeSO4 → Fe2O3 + SO2 + SO3 |
syntezy (16,4%) analizy (52,3%) wymiany (30,8%) |
| 2. | SO3 + H2O → H2SO4 |
syntezy (56,9%) analizy (25,1%) wymiany (16,9%) |
| 3. | SO2 + H2O → H2SO3 |
syntezy (54,9%) analizy (21,5%) wymiany (22,1%) |
Uczniowie osiągnęli słabe wyniki zarówno sumaryczne, jak i przy udzielaniu odpowiedzi w każdym z punktów. Wydaje się, że głównym powodem była nieznajomość (i/lub niezrozumienie) pojęć: reakcja analizy, syntezy, wymiany. W podstawie programowej zapisy dotyczące typów reakcji występują w pierwszych jej punktach i są one zwykle realizowane na początku kształcenia chemicznego, w pierwszej klasie gimnazjum. Sądząc po zawartości wielu gimnazjalnych podręczników do chemii, terminy te nie są utrwalane na dalszym etapie nauczania. Ponadto, przykłady, które są ilustracją tych przemian są zazwyczaj, z uwagi na poziom wiedzy chemicznej uczniów, bardzo proste. Substratami w reakcjach syntezy są przede wszystkim pierwiastki, a powstałe produkty są dwupierwiastkowymi związkami chemicznymi. Równania reakcji analizy przedstawiają najczęściej rozkład prostych substancji do dwóch pierwiastkowych produktów. Dlatego też uczniom było bardzo trudno odnieść się do zaprezentowanych w zadaniu równań reakcji. Wyrazem tego są osiągnięte wyniki: niezależnie od tego, czy reakcja była znana uczniom (punkty 2 i 3), czy też nie była przewidziana w postawie programowej (punkt 1) udzielanie prawidłowych odpowiedzi kształtowało się na poziomie pięćdziesięciu kilku procent. Przedstawiona w punkcie 1 reakcja analizy była prawdopodobnie dla uczniów dość nietypowa zarówno pod względem liczby powstających produktów (trzech), jak i ich składu (związki chemiczne). Podobnie zaprezentowane w punktach 2 i 3 równania reakcji syntezy zawierały substraty, które były związkami chemicznymi. Te cechy, w świetle wspomnianych wcześniej uwarunkowań, mogły okazać się wielką przeszkodą w prawidłowej ocenie typu reakcji nawet dla uczniów znających definicję poszczególnych ich rodzajów. Zjawisko to wskazuje, że nauczyciel powinien podczas wprowadzania bardziej złożonych równań reakcji starać się utrwalać pojęcia związane z typami reakcji.
Zadanie można wykorzystać na lekcji przewidzianej na realizację działu Kwasy i zasady (otrzymywanie kwasów) lub na lekcję podsumowującą dział Sole (z uwagi na pojawiający się wzór soli w zadaniu) bądź na zakończenie omawiania zagadnień z chemii ogólnej i nieorganicznej (najważniejszych grup związków). Ponadto zadanie po modyfikacji (odrzuceniu tekstu wstępnego) można użyć na lekcji omawiającej typy reakcji chemicznych. Będzie to okazja do zwrócenia uczniom uwagi, że określone typy reakcji mogą obejmować i takie, w których występują złożone reagenty.
Utwór jest chroniony prawem autorskim. Zasady i warunki korzystania z niego określa Regulamin Serwisu Bazy Dobrych Praktyk.
"Masz uwagi do treści? Uważasz, że zawiera błąd? Napisz na bnd@ibe.edu.pl





